
La unión hace la fuerza. Nunca mejor dicho que en el caso de los biofilms, las complejas comunidades de bacterias adheridas a superficies sólidas que les confieren una capacidad extraordinaria de sobrevivir a tratamientos con antibióticos o desinfectantes. Evitar su formación en entornos alimentarios u hospitalarios podria ser más fácil con un nuevo descubrimiento de científicos del CSIC.
Bacteriófagos: nuevas armas eficaces contra el biofilm
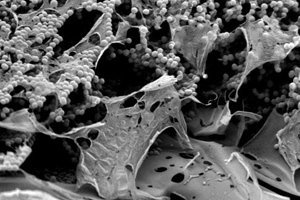 Los biofilms bacterianos son complejas comunidades de bacterias compuestas por una o diversas especies, adheridas a una superficies sólida y rodeadas por una matriz extracelular polimérica secretada por las mismas células, que les permite mantenerse unidas entre si. Estas secreciones también les facilitan adherirse a una superficie biótica (viva) o abiótica (inerte).
Los biofilms bacterianos son complejas comunidades de bacterias compuestas por una o diversas especies, adheridas a una superficies sólida y rodeadas por una matriz extracelular polimérica secretada por las mismas células, que les permite mantenerse unidas entre si. Estas secreciones también les facilitan adherirse a una superficie biótica (viva) o abiótica (inerte).
Esta matriz puede estar compuesta de diversos tipos de moléculas y confiere a las bacterias protección, una estructura física y la capacidad de intercambiar sustancias e información. En su interior, el grado de nutrientes y oxigeno determina diferencias en el estado fisiológico de las bacterias, en función de su ubicación dentro del biofilm. Además, el desarrollo del biofilm y su dispersión es un proceso bien regulado mediante sistemas de comunicación entre las células.
Estas sofisticadas estructuras son muy resistentes a la acción de antimicrobianos como los antibióticos y los desinfectantes, contribuyendo a la virulencia de las bacterias. Las hace tremendamente resistentes y supone un importante problema para tratar infecciones bacterianas o para controlar contaminaciones durante el procesado de algunos alimentos.
Con el fin de combatirlos, especialmente en ambientes especialmente sensibles, investigadores del Consejo Superior de Investigaciones Científicas (CSIC) han desarrollado una técnica que permite seguir el desarrollo de los biofilms en tiempo real y ofrece información sobre la formación de estas estructuras.
Bacteriófagos como nuevos antimicrobianos
La tolerancia de los biofilms a los antibióticos y desinfectantes ha promovido la aparición de estrategias alternativas, como el uso de bacteriófagos, virus que atacan a bacterias específicas, o de enzimas de los bacteriófagos.
El equipo de científicos del CSIC ha empleado una técnica para evaluar la eficacia de proteínas de origen fágico para evitar la formación de biofilms o para eliminar los ya creados. Para el estudio utilizaron como modelo cepas de Staphylococcus aureus y Staphylococcus epidermidis, sobre superficies compuestas de microelectrodos de oro, poliestereno y acero inoxidable.
Asimismo, el bacteriofago phi-IPLA7 y la enzima endolisina LysH5 se utilizaron como antimicrobianos para comprobar su capacidad de inhibir la formación de biofilms por los Staphylococcus, mediante un equipo de monitorización RTCA (real-time cell analysis).
El sistema hace una medición en tiempo real de la formación del biofilm y puede evaluar la capacidad de una determinada bacteria para adherirse a una superficie. El método no sólo facilita el estudio de la patogenicidad bacteriana, sino que simplifica la búsqueda de nuevos antimicrobianos y permite calcular las dosis necesarias para eliminar estos patógenos.
Después de 4-6 horas de incubación, se registraron diferencias significativas en los valores CI obtenidos para Staphylococcus aureus y Staphylococcus epidermidis en presencia de los antimicrobianos, con respecto a las muestras de control. Lo que indica, según los autores, que se evitó la formación de biofilm.
Por otra parte, también se demostró la utilidad de esta técnica para controlar la eficacia de la endolisina LysH5 sobre una biopelícula de estafilococos preformada, y se determinó la dosis más efectiva para la eliminación del biofilm.
Según los autores, se trata de una herramienta rápida, fiable y eficaz para la investigación de nuevos antimicrobianos contra las biopelículas.
Fuente: Diana Gutiérrez, Claudio Hidalgo-Cantabrana, Ana Rodríguez, Pilar García y Patricia Ruas-Madiedo. Monitoring in real time the formation and removal of biofilms from clinical related pathogens using an impedance-based technology. PLOS ONE.
Imagen: Biopelícula de ‘Staphylococcus epidermidis’ adherida a una superficie inerte. / CSIC






