
La alta prevalencia de casos de Campylobacteriosis humana en la UE y el hecho de que estudios hayan asociado entre un 20 % y un 30 % de estos casos a la preparación y el consumo de la carne de pollo de engorde, ha provocado la modificación del Reglamento (CE) n.º 2073/2005, que establece los criterios microbiológicos aplicables a los productos alimenticios, para incluir el control microbiológico de Campylobacter en canales de pollo.
Limite microbiológico para Campylobacter en canales de pollos
Según datos de la Autoridad Europea para la Seguridad Alimentaria (EFSA), se estima que en la UE las canales de pollos de engorde están contaminadas con la bacteria Campylobacter en una media del 75,8 %, con variaciones significativas entre los Estados miembros y entre los mataderos.
La campilobacteriosis humana es la enfermedad gastrointestinal con mayor número de casos registrados dentro de la UE y, según estudios realizados por la EFSA, es probable que la manipulación, la preparación y el consumo de carne de pollo de engorde representen entre un 20 % y un 30 % de los casos de campilobacteriosis humana, mientras que entre el 50 % y el 80 % se atribuye al reservorio de pollos en su conjunto.
Como opción de control, la misma EFSA considera que establecer un limite microbiológico de 1 000 ufc/g, para Campylobacter podría suponer una reducción de más del 50 % de los riesgos para la salud pública derivados del consumo de carne de pollo de engorde.
En base a esta información, hace pocos días, la CE publicó el Reglamento (UE) 2017/1495, que adapta los actuales métodos de inspección de las canales de ave de corral con relación a Campylobacter y establece un criterio de higiene del proceso para Campylobacter en canales de pollo, que tiene por objeto controlar la contaminación de las canales durante el proceso de sacrificio.
El plan de muestreo para el criterio relativo a Campylobacter deberá seguir el mismo planteamiento que el criterio de higiene del proceso para la Salmonela en las canales de aves de corral. Las mismas muestras de piel del cuello utilizadas para comprobar la conformidad con el criterio de higiene del proceso para la Salmonela pueden utilizarse para el análisis de Campylobacter.
Como método de referencia para verificar el cumplimiento del criterio para Campylobacter en las canales de ave de corral se utilizará la norma internacional EN/ISO 10272-2, que establece el método horizontal para el recuento de Campylobacter en los alimentos y los piensos.
Modificaciones en el Reglamento 2073/2005 relativo a los criterios microbiológicos en alimentos
En el anexo I se realizan las modificaciones:
1) Capítulo 2: Criterios de higiene de los procesos
a) en el punto 2.1 se añade la entrada 2.1.9 :
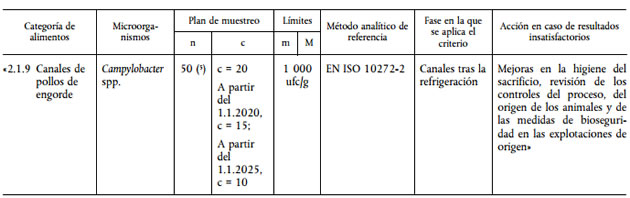
b) en el apartado «Interpretación de los resultados de las pruebas» se añade el texto siguiente:
«Campylobacter spp. en canales de pollos de engorde:
— satisfactorio, si un máximo de c/n valores es superior a m,
— insatisfactorio, si más de c/n valores son superiores a m.».
Capítulo 3: Normas para la toma de muestras y preparación de éstas para las pruebas
2) El punto 3.2 se sustituye por el texto siguiente:
3.2. Muestreo bacteriológico en los mataderos y en los locales que producen carne picada, preparados de carne, carne separada mecánicamente y carne fresca
- Normas de muestreo para las canales de aves de corral y la carne fresca de a ves de corral
Los mataderos procederán al muestreo de canales enteras de aves de corral con la piel del cuello para los análisis relativos a Campylobacter y a la Salmonela. Los centros de despiece y de transformación distintos de los adyacentes a un matadero que despiecen y transformen únicamente la carne recibida de ese matadero tomarán asimismo muestras para los análisis de detección de la Salmonela. Para la toma de muestras, darán prioridad a las canales enteras de aves de corral con la piel del cuello, si están disponibles, pero también analizarán piezas de aves con piel y/o piezas de aves sin piel o con poca piel, y la elección se hará en función del riesgo.
Cuando se realicen pruebas para comprobar el cumplimiento del criterio de higiene del proceso establecido en las entradas 2.1.5 y 2.1.9 del capítulo 2 para la detección de Campylobacter y de la salmonela en las canales de aves de corral en los mataderos, si dichas pruebas se realizan en el mismo laboratorio, en cada sesión de muestreo se tomarán muestras aleatorias de la piel del cuello de un mínimo de quince canales de aves de corral después de la refrigeración. Antes del examen, las muestras de piel del cuello procedentes de al menos tres canales de aves de corral de la misma manada de origen se mezclarán en una muestra de 26 g. De este modo, se obtendrán cinco muestras finales de 26 g de piel del cuello (se necesitan 26 gramos para realizar en paralelo el análisis de Campylobacter y de la salmonela en una sola muestra).
Las muestras deberán conservarse después del muestreo y transportarse al laboratorio a una temperatura de entre 1 °C y 8 °C; el lapso de tiempo entre la toma de muestras y las pruebas relativas a Campylobacter deberá ser inferior a 48 horas con el fin de garantizar la integridad de la muestra.
Las muestras que hayan alcanzado una temperatura de 0 °C no deberán utilizarse para verificar el cumplimiento del criterio relativo a Campylobacter. Las cinco muestras de 26 g se utilizarán para comprobar el cumplimiento de los criterios de higiene del proceso que figuran en las entradas 2.1.5 y 2.1.9 del capítulo 2 y de los criterios de seguridad alimentaria establecidos en la entrada 1.28 del capítulo 1. Con el fin de preparar la suspensión inicial en el laboratorio, la porción de ensayo de 26 gramos se transferirá a nueve volúmenes (234 ml) de agua de peptona tamponada, que se añadirá después de haber sido precalentada a temperatura ambiente. La mezcla se tratará en un Stomacher o un Pulsifier durante aproximadamente un minuto. Se evitará la formación de espuma extrayendo todo el aire posible de la bolsa del Stomacher. 10 ml (~ 1 g) de esta suspensión inicial se transferirán a una probeta estéril vacía y 1 ml de los 10 ml se empleará para el recuento de Campylobacter en placas selectivas. El resto de la suspensión inicial (250 ml ~ 25 g) se utilizará para la detección de la salmonela.
Cuando se lleven a cabo las pruebas para comprobar el cumplimiento del criterio de higiene del proceso establecido en las entradas 2.1.5 y 2.1.9. del capítulo 2 para la detección de Campylobacter y de la salmonela en las canales de aves de corral en los mataderos, si dichas pruebas se realizan en el mismo laboratorio, en cada sesión de muestreo se tomarán muestras aleatorias de la piel del cuello de un mínimo de veinte canales de aves de corral después de la refrigeración. Antes del examen, las muestras de la piel del cuello procedentes de al menos cuatro canales de aves de corral de la misma manada de origen se mezclarán en una muestra de 35 g. De este modo, se obtendrán cinco muestras de 35 g de piel del cuello, que, a su vez, se dividirán para obtener cinco muestras finales de 25 g (para el análisis de la salmonela) y cinco muestras finales de 10 g (para el análisis de Campylobacter).
Las muestras deberán conservarse después del muestreo y transportarse al laboratorio a una temperatura de entre 1 °C y 8 °C; el lapso de tiempo entre la toma de muestras y las pruebas relativas a Campylobacter deberá ser inferior a 48 horas, con el fin de garantizar la integridad de la muestra. Las muestras que hayan alcanzado una temperatura de 0 °C no deberán utilizarse para verificar el cumplimiento del criterio relativo a Campylobacter. Las cinco muestras de 25 g se utilizarán para comprobar el cumplimiento con los criterios de higiene del proceso establecido en la entrada 2.1.5 del capítulo 2 y con los criterios de seguridad alimentaria establecidos en la entrada 1.28 del capítulo 1. Las cinco muestras finales de 10 g se utilizarán para verificar el cumplimiento del criterio de higiene del procedimiento establecido en la entrada 2.1.9 del capítulo 2.
- Directrices para el muestreo
Frecuencias de muestreo para las canales, la carne picada, los preparados de carne, la carne separada mecánicamente y la carne fresca de a ves de corral
En el caso de la toma de muestras en las canales de aves de corral para la detección de Campylobacter, la frecuencia de muestreo podrá reducirse a una vez cada dos semanas si se obtienen resultados satisfactorios durante cincuenta y dos semanas consecutivas.
La frecuencia de la toma de muestras de Campylobacter podrá reducirse, previa autorización de la autoridad competente, cuando exista un programa de control nacional o regional oficial u oficialmente reconocido de Campylobacter y dicho programa incluya tomas de muestras y pruebas equivalentes a la toma de muestras y las pruebas exigidas para verificar el cumplimiento del criterio de higiene del proceso establecido en la entrada 2.1.9 del capítulo 2. En caso de que en el programa de control se fije un bajo nivel de contaminación por Campylobacter en las manadas, la frecuencia de muestreo podrá reducirse aún más si el bajo nivel de contaminación por Campylobacter se cumple durante un período de cincuenta y dos semanas en las explotaciones de origen de los pollos de engorde comprados por el matadero.
Si el programa de control arroja resultados satisfactorios durante un período determinado del año, la frecuencia de los análisis relativos a Campylobacter también podrá ajustarse a las variaciones estacionales, previa autorización de la autoridad competente.
REGLAMENTO (UE) 2017/1495 DE LA COMISIÓN de 23 de agosto de 2017 que modifica el Reglamento (CE) n.o 2073/2005 por lo que se refiere a Campylobacter en canales de pollos de engorde







